Über Säuren und Basen - Einleitung
Die geschichtliche Herausbildung des Säurebegriffes
Bevor die Menschen ein genaueres chemisches Verständnis entwickelten, wurden als Säuren Flüssigkeiten bezeichnet, die sauer schmecken. Ab dem 17. Jahrhundert kam zu dieser Definition hinzu, dass Säuren Marmor lösen und bestimmte pflanzliche Farbstoffe rot färben. Bereits im 18. Jahrhundert ging man dann bei der Definition auch auf die chemische Zusammensetzung ein – jedoch meinte man noch, alle Säuren enthielten Sauerstoff. Richtig wurde allerdings erkannt, dass Säuren bei der Reaktion von Nichtmetalloxiden mit Wasser entstehen.
Ende des 19. bzw. Anfang des 20. Jahrhundert schließlich stellte Arrhenius eine auch heute noch geläufige Säure-Definition auf: Säuren sind chemische Verbindungen, die in wässriger Lösung in frei bewegliche, elektrisch positiv geladene Wasserstoffionen (Protonen) und elektrisch negativ geladene Säurerestionen dissoziieren.
Die geschichtliche Herausbildung des Basebegriffes
Früh war bereits bekannt, dass bei der Reaktion einer Säure mit einer Base Wasser und Salz entstehen. Daher rührt auch der Name: Sie sind die Grundlage (griechisch: basis) für Säuren, um Salze zu bilden.
Arrhenius lieferte auch für Basen eine Definition, die zu derer der Säuren analog ist: Basen sind chemische Verbindungen, die in wässriger Lösung beziehungsweise in Schmelzen in frei bewegliche, elektrisch positiv geladene Metallionen und elektrisch negativ geladene Hydroxidionen dissoziieren. Die Lösung einer Base heißt Lauge oder alkalische Lösung.
Die Brønsted-Theorie
In der Praxis zeigt sich, dass die Definiton nach Arrhenius einige Mängel aufweist. So kann sie beispielsweise nicht erklären, warum eine Ammoniaklösung basisch reagiert, noch erklärt sie, warum sich in wässriger Lösung keine freien Protonen nachweisen lassen.
Die von dem dänischen Chemiker Brønsted 1923 aufgestellte Theorie besagt nun, dass an jeder Säure-Base-Reaktion zwei korrespondierende Säure-Base-Paare beteiligt sind. Das bedeutet, dass Säuren Protonen auf Basen übertragen können; Säuren sind somit als »Protonendonatoren«, Basen hingegen als »Protonenakzeptoren« zu verstehen.
Für das angeführte Beispiel der Ammoniaklösung bedeutet das also, dass ein Ammoniakmolekül als Base ein Proton aufnehmen kann. Dieses Proton stammt vom Wasser, welches in diesem Fall als Säure fungiert, und durch Protonenabgabe zu einem Hydroxidion reagiert. Somit erklärt sich also auch die basische Reaktion von Ammoniak.
Formal lässt sich diese Reaktion wie folgt beschreiben:
H2O → H+ + OH-
NH3 + H+ → NH4+
Wenn hingegen eine Säure (etwa HCl) mit Wasser reagiert, fungiert das Wasser als Base und nimmt das von der Säure abgegebene Proton auf. Dabei entsteht ein Oxoniumion und ein Säurerestion (hier Cl-).
HCl → H+ + Cl-
H2O + H+ → H3O+
Diese Reaktion kann auch in umgekehrter Richtung stattfinden, z.B. wenn das gasförmige HCl aus einer konzentrierten HCl-Lösung durch Erwärmen ausgetrieben wird. In diesem Fall fungiert das Oxoniumion als Säure sowie das Chloridion als Base.
H3O+ → H2O + H+
H+ + Cl- → HCl
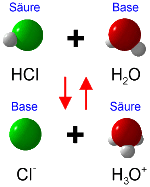 Zu jeder Säure gehöhrt folglich eine korrespondierende Base und umgekehrt. Dies verdeutlicht das eingangs erwähnte Prinzip der korrspondierenden Säure-Base-Paare, welche miteinander Säure-Base-Reaktionen eingehen können.
Zu jeder Säure gehöhrt folglich eine korrespondierende Base und umgekehrt. Dies verdeutlicht das eingangs erwähnte Prinzip der korrspondierenden Säure-Base-Paare, welche miteinander Säure-Base-Reaktionen eingehen können.
Schematisch lässt sich die Wechselwirkung zwischen korrespondierenden Säure-Base-Paaren mit folgender Reaktionsgleichung darstellen:
![]()
Die Lewis-Theorie
Neben der Brønsted-Theorie gibt es weitere Theorien, wie z.B. die Lewis-Säure-Base-Theorie. Hiernach sind Lewis-Säuren Elektronenpaarakzeptor, Lewis-Basen hingegen Elektronenpaardonator. Dies steht nicht im Widerspruch zur Brønsted-Theorie; im Gegenteil lassen sich mit der Lewis-Theorie einige Phänomene qualititv beschreiben, während die Brønsted-Theorie die nötige quantitative Beschreibung liefern kann. So sei an dieser Stelle nochmals auf Ammoniak verwiesen, welches aufgrund seines freien Elektronenpaares eine Lewis-Base darstellt. Mit Boran als Elektronenpaarakzeptor kann beispielsweise ein Addukt H3N-BH3 gebildet werden, was eine klassische Lewis-Säure-Base-Reaktion darstellt.
Da die Lewis-Theorie jedoch weniger geeignet ist, quantitative Beschreibungen von Säure-Base-Reaktionen zu liefern, soll an dieser Stelle nicht näher darauf eingegangen werden.