Inhaltsstoffe von Waschmitteln
Zusammensetzung moderner Waschmittel
Waschaktive Substanzen (Tenside)
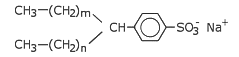
Entscheidend für die Reinigungswirkung der Waschmittel sind natürlich die grenzflächenaktiven Bestandteile, also Tenside bzw. Detergenzien. Hier sind es allerdings vordergründig keine Seifen, die zum Einsatz kommen, sondern vor allem Alkylsulfate (n = 9 ··· 17)
CH3—(CH2)n—O—SO3- Na+
und Alkylbenzolsulfonate (n + m = 7 ··· 12).
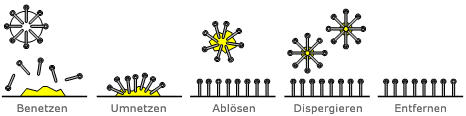
Der Schmutz wird durch ein Tensid in mehreren Schritten von einer Oberfläche gelöst; man unterscheidet hier das Benetzen, Umnetzen, Ablösen, Dispergieren und Entfernen der Bestandteile.
» mehr zur Funktionsweise von Tensiden
Gerüststoffe
Die meisten Waschmittel enthalten bestimmte Zusatz- und Hilfsstoffe. Dies sind z.B. Komplexbildner bzw. Gerüststoffe, welche mit den Calcium-Ionen im Wasser zu wasserlöslichen Komplexen reagieren und somit die Wasserhärte verringern. Dies ist notwendig, da anionische Tenside sehr wasserhärteempfindlich sind. Zudem wird durch Komplexbildung verhindert, dass sich bereits gelöster Schmutz wieder an der Wäsche festsetzt. Früher verwendete man Phosphate (PO43-) als solche Gerüststoffe – diese werden jedoch zur Vermeidung der Eutrophierung von Gewässern mehr und mehr durch anorganische Ionentauscher wie Zeolith (Natriumaluminiumsilicat) ersetzt.
Bleichmittel
Vollwaschmittel – im Gegensatz zu Feinwaschmitteln – enthalten oft Bleichmittel wie Natriumperborat (NaBO2(OH)2 · 3 H2O), Natriumpercarbonat (Na2CO3 · 3 H2O2) oder verschiedene Chlorverbindungen, welche aktiven Sauerstoff zur Zersetzung von organischen Resten (z.B. Obstresten) abspalten können.
NaBO2(OH)2 · 3 H2O → NaBO2 + H2O2 + 3 H2O → NaBO2 + 4 H2O + O:
So lassen sich färbende Begleitstoffe durch Oxidation entfernen.
Zusätzlich müssen Waschmittel so genannte Stabilisatoren enthalten, welche die unkontrollierte Zersetzung des Perborats verhindern. Des Weiteren findet man in Waschmitteln Aktivatoren, welche eine Bleichwirkung auch unter 60°C garantieren.
Sonstige Zusatzstoffe (Hilfsstoffe)
Viele Waschmittel enthalten "optische Aufheller", welche die Farbintensität der Wäsche erhöhen, indem sie ultraviolettes in sichtbares Licht umwandeln. Hierzu werden vor allem Derivate des Stilbens (C6H5—CH=CH—C6H5) verwendet.

Pulverige Waschmittel enthalten zudem so genannte Stellmittel, die die Rieselfähigkeit verbessern. Ein typisches Stellmittel ist Natriumsulfat (Na2SO4).
Besonders bei der Anwendung in Waschmaschinen werden Schaumregulatoren oder Schaumhemmer benötigt. Hierzu verwendet man Silicone ([Si(R)2—O]n) oder Parafine (CH3—(CH2)n—CH3). Viele Waschmittel sind zudem parfümiert, um einen möglicherweise durch die Tenside entstehenden Laugengeruch zu überdecken.
Weiterhin enthalten Waschmittel Enzyme, welche für die Entfernung von Fetten, Eiweißen, Kohlenhydraten und Cellulosen verantwortlich sind. Hierfür werden Enzyme wie Lipasen, Proteasen, Amylasen oder Cellulasen verwendet, die diesen "Schmutz" durch Hydrolyse in seine Bestandteile zerlegen (d.h. in Fettsäuren und Glycerin, Aminosäuren bzw. Maltose und Glucose).
Weichspüler bzw. Weichspülmittel sind an sich nichts anderes als kationische Tenside, welche Synthesefasern antistatisch machen und der Wäsche somit einen weiche Griff verleihen.
Vergrauungsinhibitoren sorgen dafür, dass die die Wäsche nicht vorzeitig vergraut, indem sie eine Wiederablagerung der Schmutzteilchen aus der Waschlauge auf Textilen verhindern. Dieser Effekt wird im Waschmittel durch Carboxymethylcellulose erwirkt.
Farbübertragungsinhibitoren sind vor allem bei Buntwäsche von Bedeutung, da sie Verfärbungen der Wäsche verhindern. Meist handelt es sich hierbei um Polyvinylpyrrolidon.
Zudem ist es bei Flüssigwaschmitteln wichtig, dass es nicht zu einer Phasentrennung der Bestandteile kommt. Entsprechend enthalten solche Waschmittel Lösungsvermittler – verschiedene Alkohole – welche diesen Effekt verhindern.
Schließlich enthalten Waschmittel auch noch Korrosionsschutzmittel (oder auch Korrosionsinhibitoren), damit sich keine Korrosion an der Waschmaschine einstellt. Hierfür werden vor allem Magnesium- und Natriumsilicate eingesetzt.
Experiment: Eigenschaften eines anionischen Tensids
![]()
![]() Sicherheitshinweis: Natronlauge und Salzsäure sind ätzend! Calciumchlorid ist reizend. Schutzkleidung und Schutzbrille tragen!
Sicherheitshinweis: Natronlauge und Salzsäure sind ätzend! Calciumchlorid ist reizend. Schutzkleidung und Schutzbrille tragen!
Materialien: Reagenzgläser, Reagenzglasgestell, Pipette, Uhrglasschale, Erlenmeyerkolben
Chemikalien: Tensid (z.B. Waschmittel oder Flüssigseife), Wasser, Universalindikator, Salzsäure, Natronlauge, Öl, Kochsalz, Calciumchlorid
Durchführung: Reaktionsverhalten in Wasser. Etwas Waschmittel in ein wenig Wasser lösen, pH-Wert ermitteln.
Reaktion mit Säuren und Basen. Erneut Tensid in Wasser lösen, zu einer Probe Salzsäure, zu einer anderen Natriumhydroxid zugeben und Veränderungen beobachten. Gegebenfalls pH-Wert ermitteln.
Benetzende Wirkung. Circa 5 ml Wasser auf eine Uhrglasschale geben, darauf eine Büroklammer o.ä. zum "Schwimmen" bringen. Flüssiges Tensid hinzugeben.
Emulgierverhalten. In zwei Erlenmeyerkolben Öl und Wasser geben. In einen der Kolben zusätzlich Tensid hinzugeben. Beide Kolben schütteln.
Wasserhärteempfindlichkeit. Calciumchlorid in Wasser lösen, Tensid dazugeben.
Aussalzen. Mit Natriumchlorid eine gesättigte Lösung herstellen, Tensid dazugeben.
Beobachtung: Reaktionsverhalten in Wasser. Das Tensid reagiert in Wasser basisch.
Reaktion mit Säuren und Basen. Bei Säurezugabe fällt ein weiß-grauer Niederschlag aus, bei Basezugabe geschieht nichts.
Benetzende Wirkung. Bei Zugabe eines Tensids sinkt die Büroklammer zu Boden.
Emulgierverhalten. Im Reagenzglas ohne Tensid setzt sich das Öl nach kurzer Zeit wieder an der Wasseroberfläche ab, im Reagenzglas mit Tensid bildet sich jedoch eine dauerhafte Emulsion.
Wasserhärteempfindlichkeit. Bei Zugabe von Calciumionen fällt ein weißer, nicht löslicher Niederschlag aus.
Aussalzen. In einer gesättigten Lösung fällt ein weißer Niederschlag aus, welcher bei Wasserzugabe jedoch wieder verschwindet.
Auswertung: Da es sich um ein anionisches Tensid handelt, enthält es mindestens eine Carboxylatgruppe (—COO-), die für viele der vorangehenden Beobachtungen verantwortlich ist. Mit Wasser z.B. reagiert ein geringer Teil des Tensids zu Fettsäuren und Hydroxidionen, welche die leicht basische Reaktion ausmachen:
R—COO- + H2O ⇋ R—COOH + OH-
Durch Basezugabe wird dieses Gleichgewicht entsprechend auf die Seite der Ausgangsprodukte verschoben, weshalb keine Reaktion festgestellt werden kann. Wird jedoch Säure hinzugegeben, verlagert sich das Gleichgewicht auf die Seite der Reaktionsprodukte, weil die Hydroxidionen aus dem Gleichgewicht entzogen werden. Hierbei kann aufgrund einer sehr geringen Rückreaktion von einem vollständigen Stoffumsatz ausgegangen werden.
R—COO- + H3O+ → R—COOH + H2O
Die nicht-wasserlöslichen Fettsäuren bilden einen weiß-grauen Niederschlag, welcher auch für das Vergrauen von Wäsche verantwortlich gemacht werden kann.
Die Wasserhärteempfindlichkeit von anionischen Tensiden lässt sich ebenfalls anhand der Carboxylatgruppe erklären:
2 R—COO- + Ca2+ → (R—COO)2Ca
Es bildet sich ein schwerlösliches Calciumsalz. Ähnlich verhält es sich bei Zugabe einer gesättigten Kochsalzlösung, jedoch ist dieser Prozess reversibel. Die etwas schlechtere Löslichkeit des organischen Salzes gegenüber dem Kochsalz führt hier dazu, dass es anstelle des Kochsalzes ausfällt.
Die benetzende Wirkung des Tensids und das Emulgierverhalten haben hingegen mit dem gesamten Aufbau eines Tensidmoleküls zu tun. Hier spielen die hydrophoben und hydrophilen Eigenschaften eine Rolle. Die Oberflächenspannung des Wassers wird durch das Tensid – wie im Kapitel über Seifenmoleküle beschrieben – heruntergesetzt, sodass die Büroklammer plötzlich durch die Oberfläche des Wassers "hindurchfällt". Ebenso wird das Öl im Wasser durch die Grenzflächenaktivität des Tensids im Wasser emulgiert.
Experiment: Untersuchung der Wasserhärte
Materialien: Erlenmeyerkolben, Pipette
Chemikalien: Leitungswasser, Destilliertes Wasser, Seifenlösung
Durchführung: Leitungswasser und destilliertes Wasser je in einen Erlenmeyerkolben füllen, Tensidlsg. tropfenweise dazugeben. Schaumwirkung beobachten
Beobachtung: Im Erlenmeyerkolben mit destilliertem Wasser bildet sich schneller und mehr Schaum als im Kolben mit Leitungswasser.
Auswertung: Im normalen Leitungswasser befinden sich unter anderem Ca2+-Ionen, welche mit dem Tensid zu einem schwer löslichen Calciumsalz reagieren. Folglich bildet sich erst Schaum, wenn keine Reaktion mehr stattfindet, d.h. wenn sich zwischen Calciumionen und Tensidmolekülen ein Gleichgewicht eingestellt hat und das Tensid nunmehr in Überschuss vorliegt. Im destillierten Wasser befinden sich keine Fremdstoffe, entsprechend kommt es hier sofort zur Schaumbildung.
Experiment: Nachweis von Soda in Waschmitteln
![]() Sicherheitshinweis: Bariumhydroxid und Salzsäure sind ätzend! Schutzkleidung und Schutzbrille tragen!
Sicherheitshinweis: Bariumhydroxid und Salzsäure sind ätzend! Schutzkleidung und Schutzbrille tragen!
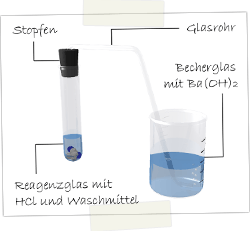 Materialien: Reagenzglas, Stopfen, Glasrohr, Becherglas
Materialien: Reagenzglas, Stopfen, Glasrohr, Becherglas
Chemikalien: Pulvriges Waschmittel, Salzsäure, Bariumhydroxidlösung
Durchführung: Das Waschmittel wird zusammen mit der Salzsäure in das Reagenzglas gegeben. Sofort Stopfen befestigen! Das entstehende Gas wird durch die Bariumhydroxidlösung im Becherglas geleitet.
Beobachtung: In der Bariumhydroxidlösung entsteht ein weißer Niederschlag, sobald das entstehende Gas durch die Lösung geleitet wird.
Auswertung: Die Salzsäure reagiert mit dem Natriumcarbonat im Waschmittel zu Natriumchlorid und Kohlenstoffdioxid.
Na2CO3 + 2 HCl → 2 NaCl + H2O + CO2
Das gasförmige Kohlenstoffdioxid entweicht und reagiert beim Durchleiten durch die Bariumhydroxidlösung mit dieser zu schwerlöslichem Bariumcarbonat.
Ba(OH)2 + CO2 → BaCO3 + H2O
Dieses fällt als weißer Niederschlag aus.
Experiment: Waschwirkung eines Tensids
Materialien: Textilproben (z.B. Wollgarn), Becherglas, Glasstab
Chemikalien: Kohlenstoff (Ruß), Wasser, Flüssigseife
Durchführung: Textil mit Ruß anschmutzen und in Becherglas mit Wasser geben. Mit Glasstab leicht rühren. Seife dazugeben und erneut rühren.
Beobachtung: Im reinen Wasser wird nur wenig Ruß vom Garn gelöst, bei Seifenzusatz löst sich der Schmutz fast vollständig.
Auswertung: Einige Rußpartikel werden bereits vom Wasser abgespült, da sie sich nicht zwischen den Fasern festgesetzt haben. Die restlichen Partikel können allerdings erst nach Zusatz der Seife gelöst werden, da sich hierdurch die Oberflächenspannung des Wassers verringert und es somit zwischen die Fasern eindringen und die tiefer sitzenden Partikel fortspülen kann.
Experiment: Wirkung von Bleichmitteln
![]() Sicherheitshinweis: Natriumperborat ist giftig! Schutzkleidung und Schutzbrille tragen!
Sicherheitshinweis: Natriumperborat ist giftig! Schutzkleidung und Schutzbrille tragen!
Materialien: Reagenzgläser, Reagenzglasgestell, Baumwolllappen, Brenner
Chemikalien: Natriumperborat, Vollwaschmittel, Wasser, Tinte
Durchführung: Drei Fetzen des Baumwolllappens in Tinte tränken und in je ein Reagenzglas mit Wasser, Vollwaschmittel bzw. Natriumperborat geben. Auf etwa 50°C erhitzen.
Beobachtung: Der Baumwolllappen im Wasser entfärbt sich kaum, der Lappen im Reagenzglas mit dem Waschmittel ist hinterher noch leicht bläulich gefärbt, und der Lappen im Bleichmittel Natriumperborat wird wieder weiß.
Auswertung: Das Natriumperborat zerfällt und setzt dabei Wasserstoffperoxid frei. Dieses reagiert mit den im Wasser enthaltenen OH--Ionen zu Perhydroxyl-Anionen, welche die Tinte von der Baumwolle durch Bleichung entfernen.
NaBO2(OH)2 + H2O → NaH2BO3 + H2O2
H2O2 + OH- → H2O + HOO-
Da das Waschmittel nicht komplett aus Bleichmittel besteht, ist die Wirkung logischerweise geringer als beim Natriumperborat.