Der pH-Wert
Der pH-Wert ist ein Maß für den Gehalt an Oxoniumionen in einer wässrigen Lösung und wird als der negative dekadische Logarithmus der Konzentration (genauer: Aktivität) der Wasserstoff- beziehungsweise Oxoniumionen definiert.
pH = -lg c(H3O+)
Dabei wird die Konzentration der Oxoniumionen auf 1 mol je Liter normiert.
Das »Gegenstück« zum pH-Wert ist der sogenannte pOH-Wert, welcher die Konzentration an Hydroxidionen in einer Lösung beschreibt.
pOH = -lg c(OH-)
Da Wasser – wie bereits eingangs beschrieben – sowohl Säure als auch Base sein kann, unterliegt es einer Eigendissoziation, der sogenannten Autoprotolyse:
2 H2O ⇋ H3O+ + OH-
Diese Gleichgewichtsreaktion kann durch das Ionenprodukt des Wassers charakterisiert werden. Da selbiges unter Standardbedingungen eine Konstante darstellt, ergibt sich für pH- und pOH-Wert folgende Beziehung:
pH + pOH = 14
Folglich sind die Konzentrationen von Oxonium- und Hydroxidionen voneinander abhänging, und zwar derart, dass eine hohe Oxonium-Konzentration eine kleine Hydroxid-Konzentration bedingt bzw. umgekehrt.
Die pH-Skala
Die klassische pH-Skala reicht von 0 bis 14, wobei der pH-Wert 0 eine große Konzentration an Oxoniumionen (100 mol je Liter) – also eine stark saure Lösung – und der pH-Wert 14 eine kleine Konzentration an Oxoniumionen (10-14 mol je Liter) – also eine stark alkalische Lösung – anzeigt.
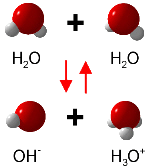 Reines Wasser und neutrale Lösungen besitzen den pH-Wert 7, da bei der Autoprotolyse genauso viele Oxonium- wie Hydroxidionen entstehen.
Reines Wasser und neutrale Lösungen besitzen den pH-Wert 7, da bei der Autoprotolyse genauso viele Oxonium- wie Hydroxidionen entstehen.
2 H2O ⇋ H3O+ + OH-
Aufgrund der oben genannten Beziehung zwischen pH und pOH muss jedoch bei gleicher Oxonium- und Hydroxid-Konzentration gelten:
pH = pOH = 7
Die Konzentration der Oxonium- und Hydroxidionen beträgt also jeweils 10-7 mol je Liter.
Die Bedeutung des pH-Wertes
Der pH-Wert hat eine große praktische Bedeutung. Kulturpflanzen zum Beispiel benötigen Böden mit ganz bestimmten pH-Werten: Weizen braucht einen pH-Wert von 6,5 bis 7,8 und Zuckerrüben einen pH-Wert von 7 bis 8, Blaubeeren einen pH-Wert von 4 bis 5 und Rhododendren einen pH-Wert zwischen 4,5 und 5,0. Gartenböden haben im allgemeinen pH-Werte zwischen 6 und 7. Durch dieses Wissen kann man unter anderem die optimale Düngermenge ermitteln – wenn zum Beispiel ein kalkhaltiger Dünger verwendet wird, kann eine Überdüngung dazu führen, dass der Boden zu alkalisch wird und die Pflanzen eingehen. Andererseits kann man aber auch den pH-Wert durch das Kalken des Bodens gezielt anheben.
Unser Körper bevorzugt ebenfalls bestimmte pH-Werte: So fühlt sich unsere Haut bei einem pH-Wert von 5,5 am wohlsten – deshalb sind Shampoos und Kosmetika mit diesem pH-Wert besonders hautverträglich. Normale Seife mit einem pH-Wert von 7,5 hingegen zerstört den Säureschutzmantel der Haut und ist somit nicht besonders hautverträglich.
In Hochmooren kann das Bodenwasser pH-Werte bis 3,5 besitzen. Folglich können hier nur besonders angepasste Lebewesen existieren. Auch Fäulnisprozesse werden durch den hohen Säuregehalt eingeschränkt – deshalb findet man in Mooren häufig die sogenannten »Moorleichen«, sowie andere organische Stoffe, die sehr gut erhalten sind.
Wichtig ist der pH-Wert auch für die Eigenschaften von Lebensmitteln: Der Geschmack von Käse zum Beispiel hängt unter anderem vom pH-Wert beim Reifeprozess ab. Und Wiener Würstchen knacken nur so richtig, wenn das Schweinefleisch einen pH-Wert von circa 6 hat.
Ebenfalls für die Industrie ist der pH-Wert von Bedeutung. Einerseits müssen Industrieabwässer der Umweltverträglichkeit halber einen pH-Wert zwischen 5 und 9 haben. Andererseits ist der saure Regen durch die »industrielle Revolution« immer mehr zum Problem geworden. Saurer Regen verursacht zum Beispiel Waldsterben, weil die Böden versauern und somit nicht mehr den von den Pflanzen benötigten pH-Wert haben. Aus diesem Grund ist es notwendig, die Emission von Schwefel- und Stickoxiden, welche die Hauptverursacher des sauren Regens sind, zu reduzieren.
Indikatoren
Ganz allgemein sind Indikatoren (lat.: indicare = anzeigen) Hilfsmittel, die bestimmte Zustände bzw. Zustandsänderungen eines chemischen Systems anzeigen können, beispielsweise durch Farbveränderung. Indikatoren, welche in Abhängigkeit der Oxoniumionenkonzentration ihre Farbe ändern, nennt man pH-Indikatoren.
Es gibt verschiedene pH-Indikatoren mit einem oder auch mehreren Umschlagsbereichen. Als Umschlagsbereich bezeichnet man dabei das pH-Intervall, in dem der Indikator seine Farbe verändert. Zumeist umfasst ein Umschlagsbereich ca. 2 pH-Einheiten.
Universalindikatoren besitzen mehrere Umschlagsbereiche, die sich über die gesamte pH-Skala verteilen. Dies wird in der Regel erreicht, indem mehrere pH-Indikatoren mit unterschiedlichen Umschlagsbereichen vermischt werden. So lässt sich mittels Farbvergleich anhand einer Farbskala der pH-Wert auf eine Einheit genau ermitteln. Es gibt allerdings auch natürliche Farbstoffe, die aufgrund mehrerer Protonisierungsstufen ein ähnliches Verhalten zeigen. Für genauere Bestimmungen des pH-Wertes sind sie hingegen selten geeignet, da häufig auch andere Faktoren wie Verdünnung und Zusammensetzung der Lösung eine Rolle spielen.
»Einfache« Indikatoren besitzen meist nur einen Umschlagsbereich. Über den pH-Wert lässt sich mittels eines solchen Indikators zunächst nicht viel in Erfahrung bringen, lediglich ob er ober- oder unterhalb des Umschlagsbereiches liegt. Jedoch haben Indikatoren mit einem oder zwei entfernt liegenden, definierten Umschlagsbereichen eine große Bedeutung für Titrationen, mit denen sich z.B. die Konzentration einer Säure oder Base sehr genau bestimmen lässt.
Die Farbveränderungen des pH-Indikators sind auf die Reaktion des Indikatorfarbstoffes mit den Oxoniumionen zurückzuführen. Einfach ausgedrückt verändert sich durch die Protonisierung die elektronische Struktur des Moleküls, wodurch Licht anderer Frequenzen absorbiert wird, und das abgestrahlte Licht folglich in einer anderen Farbe erscheint.
Farben und Umschlagsbereiche verschiedender Indikatoren
 Der wahrscheinlich bekannteste pH-Indikator ist der Universalindikator »Unitest«, welcher pH-Werte zwischen 0 und 14 anzeigen kann.
Im sauren Bereich färbt sich »Unitest« rot (pH 0 - 2) bis orange (pH 3 - 4) und gelb (pH 5 - 6), im neutralen Bereich grün (pH 7) und im alkalischen Bereich von grün-blau (pH 8 - 9) über hellblau (pH 10 - 12) bis dunkelblau (pH 13 - 14).
Der wahrscheinlich bekannteste pH-Indikator ist der Universalindikator »Unitest«, welcher pH-Werte zwischen 0 und 14 anzeigen kann.
Im sauren Bereich färbt sich »Unitest« rot (pH 0 - 2) bis orange (pH 3 - 4) und gelb (pH 5 - 6), im neutralen Bereich grün (pH 7) und im alkalischen Bereich von grün-blau (pH 8 - 9) über hellblau (pH 10 - 12) bis dunkelblau (pH 13 - 14).
Phenolphthaleinlösung besitzt einen genauen Umschlagsbereich zwischen pH 8,4 und 10,0. Im Bereich unter dem pH-Wert 8,4 ist sie farblos, im Umschlagsbereich färbt sie sich dann allmählich rotviolett und behält darüber diese Färbung bei.
Weiterhin gibt es noch Lackmus, einen pflanzlichen Farbstoff aus Flechten (Gattung Variolaria), der einen Umschlagsbereich von pH 5 bis 8 besitzt. Im sauren Bereich färbt es sich rot, im alkalischen blau bis blauviolett.
» siehe auch: Liste verschiedener Indikatoren und ihrer Umschlagsbereiche
Messung von pH-Werten
Um pH-Werte mit einem pH-Universalindikator möglichst genau bestimmen zu können, benutzt man Farbschablonen, anhand welchen sich die Färbung des Indikators einem pH-Wert zuordnen lässt.
pH-Werte lassen sich allerdings nicht nur mit pH-Indikatoren, sondern auch mit technischen Hilfsmitteln wie einem pH-Meter bestimmen. Diese elektrochemische Methode liefert sehr genaue Messergebnisse, ohne dabei die Lösung chemisch zu verändern, wie es beispielsweis durch Zusatz eines Indikators der Fall ist. Verwendet wird zumeist eine Glaselektrode, an welcher sich in Abhängigkeit des pH-Wertes eine Spannung zwischen der Messelektrode und einer Referenzelektrode aufbaut. Durch Messung dieser Spannung kann der pH-Wert direkt errechnet werden.