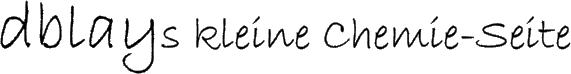Experimente
 Experimente machen die ganze Theorie natürlich erst interessant! Deshalb haben wir auf dieser Seite einige Experimentieranleitungen zusammengestellt.
Experimente machen die ganze Theorie natürlich erst interessant! Deshalb haben wir auf dieser Seite einige Experimentieranleitungen zusammengestellt.
Alle Experimente wurden von uns sorgfältig recherchiert und selbst durchgeführt, um möglichst sicherzustellen, dass von den Versuchen kein unkalkulierbares Risiko ausgeht. Daher bitten wir euch, die Sicherheitshinweise unbedingt zu befolgen!
Bitte seid euch auch bewusst, dass ihr alle Experimente, die ihr hier findet, auf eigene Gefahr und Verantwortung hin ausführt, und wir keinerlei Haftung für eventuelle Schäden übernehmen, die infolge eines oder mehrerer dieser Versuche entstanden sind.
In der Kategorie "Experimente für zu Hause" gibt es auch ein paar Versuche, die relativ ungefährlich mit normalen Haushaltsmitteln durchgeführt werden können – was aber nicht bedeutet, dass hier keine Vorsicht walten müsse!
» Experimente als RSS-Feed abonnieren
» Alle Experimente in der Kurzübersicht anzeigen
Experimente für zu Hause
Unsere "Experimente für zu Hause" beinhalten verschiedene Versuche, die relativ gefahrlos auch zu Hause mit gewöhnlichen Haushaltsmitteln durchgeführt werden können. Bitte beachtet dennoch die Gefahrenhinweise auf Reinigungsmitteln, Lacken, Lösemitteln etc.
Experimente zum Thema Waschmittel
Die Kategorie beinhaltet Experimente rund um das Thema "Waschmittel" – unter anderem erfahrt ihr, wie man eine einfache Seife herstellen kann, oder wie sich die Eigenschaften eines Tensids untersuchen lassen.
Experiment: Kristallzucht mit Kupfersulfat
![]()
![]() Sicherheitshinweis: Beim Umgang mit Kupfersulfat ist Vorsicht angebracht! Kupfersulfatlösungen dürfen nicht in den Ausguss gekippt werden. Das Verschlucken oder Trinken von Kupfersulfat bzw. Kupfersulfatlösung ist gesundheitsschädlich.
Sicherheitshinweis: Beim Umgang mit Kupfersulfat ist Vorsicht angebracht! Kupfersulfatlösungen dürfen nicht in den Ausguss gekippt werden. Das Verschlucken oder Trinken von Kupfersulfat bzw. Kupfersulfatlösung ist gesundheitsschädlich.

Chemische Grundlagen: Kupfersulfat (oder genauer: Kupfersulfat-Pentahydrat, CuSO4 · 5 H2O) ist, wie man im Bild rechts sehen kann, ein hellblaues Salz. Es ist sehr gut in Wasser löslich und färbt eine wässrige Lösung in einem kräftigen Blau.
In den folgenden Versuchen wird die Tatsache genutzt, dass Kupfersulfat in warmem Wasser sehr viel besser löslich ist als in kaltem. Wenn man also eine gesättigte Lösung in warmem Wasser herstellt und diese dann abkühlen lässt, entsteht eine so genannte übersättigte Lösung. Aus dieser scheidet sich leicht das überschüssige Kupfersulfat ab, bis wieder eine gesättigte Lösung erreicht wird.
Geräte und Chemikalien: Für die folgenden Experimente benötigt man Kupfersulfat (je mehr desto besser – wir empfehlen mindestens 50 Gramm). Auf Internetplattformen wie z.B. eBay kann man das recht günstig für ca. 5-10 Euro pro Kilogramm käuflich erwerben.

Darüber hinaus benötigt man:
- Brenner mit Ceranplatte
- ein großes Becherglas (Erlenmeyerkolben sind ungeeignet, da sich das Gefäß nicht nach oben verjüngen darf!)
- Plastik-Löffel o.ä. (unbedingt nichtmetallisch!)
- Filterpapier, Küchentuch
- ein Feuerzeug oder Streichholz
- Wasser (bevorzugt destilliertes, Leitungswasser auch möglich)
Für Experiment 2 zudem:
- ein weiteres Becherglas
- Filtriertrichter, weiches Filterpapier
- Bindfaden
- ein Stift o.ä., der lang genug ist, um nicht in das Becherglas zu fallen
Experiment 1: Züchten einer Kristallgruppe. Dieses Experiment ist verhältnismäßig einfach und bringt trotzdem eine sehr dekorative Gruppe aus kleinen Kristallen hervor.
Anleitung: Zunächst wird Wasser in das Becherglas gefüllt. Pro Gramm Kupfersulfat sollten nicht mehr als 2 ml Wasser verwendet werden. In dem kalten Wasser wird bereits etwas Kupfersulfat in Lösung gebracht und dann vorsichtig erwärmt (Siedeverzug vermeiden!).

Während sich das Wasser erwärmt, kann immer wieder mit dem Plastiklöffel Kupfersulfat zugegeben werden, da sich unter der Temperaturerhöhung immer mehr Salz löst. Man wartet bis das Wasser kurz vor dem Kochen ist und stellt sicher, dass sich auch nach mehrmaligem Umrühren nichts mehr löst. (Bei diesem Experiment ist ein Bodensatz von ungelöstem Kupfersulfat sogar hilfreich). Dann deckt man das Becherglas mit einem Filterpapier ab und lässt es in Ruhe an der Luft abkühlen. Dies kann einige Stunden dauern; während dieser Zeit sollte man das Becherglas auch wirklich an einem Standort ruhen lassen.
Wenn alles geklappt hat, sollte am Boden nun eine Gruppe von vielen Kristallen zu erkennen sein, die während der Abkühlung entstanden ist. Nachdem man die überschüssige Kupfersulfatlösung abgetrennt hat (diese ist natürlich wiederverwendbar), kann man die Kristallgruppe vorsichtig vom Boden des Becherglases trennen. Diese sollte man dann noch kurz vorsichtig mit einem Küchentuch abtupfen.
Experiment 2: Züchten eines großen Kristalls. Dieses Experiment ist im Vergleich zum ersten deutlich aufwändiger und kann leichter schief gehen. Es erfordert eine gewisse Übung, also nicht entmutigen lassen, wenn es nicht aus Anhieb klappt!
Anleitung: Zunächst wird ein Impfkristall benötigt. Ein Impfkristall ist ein Kristall mit einer Größe von mind. 0,5 cm und kann beispielsweise aus der in Experiment 1 hergestellten Kristallgruppe vorsichtig herausgetrennt werden. Dieser Impfkristall wird an einer günstigen Stelle (am besten an einer kleinen Einkerbung o.ä.) mit Bindfaden umwickelt und doppelt zugeknotet. Die andere Seite des Fadens wird an einem Stift o.ä, der lang genug ist, dass man ihn auf das Becherglas legen kann ohne das er hineinfällt, befestigt. Wichtig ist außerdem, dass der Faden so lang ist, dass er später den Impfkristall in die Lösung tauchen kann.
Wenn der Impfkristall präpariert ist, wird genau wie in Experiment 1 eine heiße gesättigte Lösung hergestellt. Da wir diesmal aber keinen Bodensatz haben wollen, wird die heiße Lösung in ein anderes Becherglas umgefüllt und dabei filtriert. In das neue Becherglas wird der Impfkristall gehängt – und zwar so, dass er in die Lösung eintaucht, jedoch nicht den Boden berührt. Anschließend sollte das Becherglas rasch mit einem Filterpapier o.ä. zudeckt werden, damit sich ein Phasengleichgewicht zwischen Dampfphase und Lösungsphase einstellen kann. Andernfalls beginnt die Lösung von der Oberfläche her auszukristallisieren.

Wichtig ist es, hierbei darauf zu achten, dass die Lösung wirklich gesättigt ist, ansonsten kann es passieren, dass sich der Impfkristall auflöst und dann nach einer Weile wieder unkontrolliertes Kristallwachstum am Boden beginnt.
Wenn alles geklappt hat, sollte der Impfkristall zu wachsen beginnen. Man sollte das Wachstum überwachen, ansonsten kann es passieren, dass er am Boden festwächst. Wer besonders große Kristalle möchte, kann auch einen einmal gezüchteten Kristall erneut als Impfkristall verwenden und weiter wachsen lassen.
Überhaupt gilt: Bei der Zucht von Kupfersulfatkristallen kann man kreativ sein, die beiden hier vorgestellten Experimente sind nur Anregungen!
Übersicht: Nachweise für Kationen
Sicherheitshinweis: Bitte beachtet die Sicherheitshinweise auf den Etiketten der Chemikalien.
 H3O+ [Oxonium-Ion]
H3O+ [Oxonium-Ion]
Nachweismittel: pH-Indikator, z.B. Unitest, Rotkohlsaft
Beobachtung: rote Färbung (indikatorabhängig)
 NH4+ [Ammonium-Ion]
NH4+ [Ammonium-Ion]
Nachweismittel: aq. NaOH, feuchtes pH-Indikatorpapier
Beobachtung: bei Zugabe von NaOH entweicht NH3 (g), welches das Indikatorpapier blau färbt
 Li+ [Lithium-Ion]
Li+ [Lithium-Ion]
Nachweismittel: Flammenprobe
Beobachtung: färbt Flamme kaminrot
 Na+ [Natrium-Ion]
Na+ [Natrium-Ion]
Nachweismittel: Flammenprobe
Beobachtung: färbt Flamme gelb
 K+ [Kalium-Ion]
K+ [Kalium-Ion]
Nachweismittel: Flammenprobe
Beobachtung: färbt Flamme violett
![]() — oder —
— oder —
Nachweismittel: aq. HClO4
Beobachtung: weißer Niederschlag aus KClO4
 Rb+ [Rubidium-Ion]
Rb+ [Rubidium-Ion]
Nachweismittel: Flammenprobe
Beobachtung: färbt Flamme violett
 Cs+ [Caesium-Ion]
Cs+ [Caesium-Ion]
Nachweismittel: Flammenprobe
Beobachtung: färbt Flamme blau
 Mg2+ [Magnesium-Ion]
Mg2+ [Magnesium-Ion]
Nachweismittel: aq. (NH4)2HPO4 + aq. NH3
Beobachtung: weißer Niederschlag aus Mg(NH4)PO4 · 6 H2O
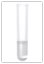 Ca2+ [Calcium-Ion]
Ca2+ [Calcium-Ion]
Nachweismittel: HOOC—COOH
Beobachtung: weißer Niederschalg aus CaC2O4
 Cu2+ [Kupfer(II)-Ion]
Cu2+ [Kupfer(II)-Ion]
Nachweismittel: Flammenprobe
Beobachtung: färbt Flamme grün
![]() — oder —
— oder —
Nachweismittel: aq. K4[Fe(CN)6]
Beobachtung: brauner Niederschlag aus Cu2[Fe(CN)6]
![]() — oder —
— oder —
Nachweismittel: aq. NH3
Beobachtung: tiefblaue Färbung durch [Cu(NH3)4]2+
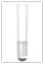 Pb2+ [Blei(II)-Ion]
Pb2+ [Blei(II)-Ion]
Nachweismittel: aq. H2S
Beobachtung: schwarzer Niederschalg aus PbS
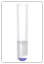 Fe3+ [Eisen(III)-Ion]
Fe3+ [Eisen(III)-Ion]
Nachweismittel: aq. K4[Fe(CN)6]
Beobachtung: blauer Niederschalg aus Fe4[Fe(CN)6]3
![]() — oder —
— oder —
Nachweismittel: aq. NH4SCN
Beobachtung: blutrote Färbung durch Fe(SCN)3
Übersicht: Nachweise für Anionen
Sicherheitshinweis: Bitte beachtet die Sicherheitshinweise auf den Etiketten der Chemikalien.
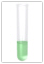 OH- [Hydroxid-Ion]
OH- [Hydroxid-Ion]
Nachweismittel: pH-Indikator, z.B. Unitest, Rotkohlsaft
Beobachtung: blaue oder grüne Färbung (indikatorabhängig)
 F- [Fluorid-Ion]
F- [Fluorid-Ion]
Nachweismittel: aq. AgNO3
Beobachtung: weißer Niederschlag aus AgF
 Cl- [Chlorid-Ion]
Cl- [Chlorid-Ion]
Nachweismittel: aq. AgNO3
Beobachtung: dunkel-weißer Niederschlag aus AgCl
 Br- [Bromid-Ion]
Br- [Bromid-Ion]
Nachweismittel: aq. AgNO3
Beobachtung: gelblich-weißer Niederschlag aus AgBr
 I- [Iodid-Ion]
I- [Iodid-Ion]
Nachweismittel: aq. AgNO3
Beobachtung: gelber Niederschlag aus AgI
 S2- [Sulfid-Ion]
S2- [Sulfid-Ion]
Nachweismittel: aq. Pb(NO3)2
Beobachtung: schwarzer Niederschlag aus PbS
 SO42- [Sulfat-Ion]
SO42- [Sulfat-Ion]
Nachweismittel: aq. BaCl2
Beobachtung: weißer Niederschlag aus BaSO4
 CO32- [Carbonat-Ion]
CO32- [Carbonat-Ion]
Nachweismittel: aq. Ba(OH)2
Beobachtung: weißer Niederschlag aus BaCO3
 NO3- [Nitrat-Ion]
NO3- [Nitrat-Ion]
Nachweismittel: aq. FeSO4 + H2SO4
Beschreibung: Lösung mit aq. FeSO4 versetzen, dann mit verd. H2SO4 ansäuern. Unterschichten mit konz. H2SO4
Beobachtung: brauner Ring aus [Fe(H2O)5NO]2+
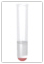 CrO42- [Chromat-Ion]
CrO42- [Chromat-Ion]
Nachweismittel: aq. AgNO3
Beobachtung: roter Niederschlag aus Ag2CrO4
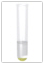 PO43- [Phosphat-Ion]
PO43- [Phosphat-Ion]
Nachweismittel: 1 g (NH4)6Mo7O24 · 4 H2O + 2 g NH4NO3 in 10 ml H2O lösen + 10 Tr. konz. NH3
Beschreibung: Probelsg. mit 10 Tr. konz. HNO3 ansäuern, Reagenzlsg. zugeben, ggf. erwärmen (Reaktion kann verzögert eintreten)
Beobachtung: gelber Niederschlag