Experimente zum Thema Waschmittel
Die Kategorie beinhaltet Experimente rund um das Thema "Waschmittel" – unter anderem erfahrt ihr, wie man eine einfache Seife herstellen kann, oder wie sich die Eigenschaften eines Tensids untersuchen lassen.
Experiment: Nachweis von Soda in Waschmitteln
![]() Sicherheitshinweis: Bariumhydroxid und Salzsäure sind ätzend! Schutzkleidung und Schutzbrille tragen!
Sicherheitshinweis: Bariumhydroxid und Salzsäure sind ätzend! Schutzkleidung und Schutzbrille tragen!
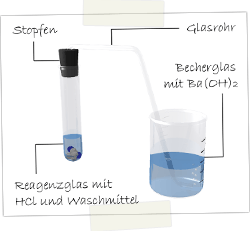 Materialien: Reagenzglas, Stopfen, Glasrohr, Becherglas
Materialien: Reagenzglas, Stopfen, Glasrohr, Becherglas
Chemikalien: Pulvriges Waschmittel, Salzsäure, Bariumhydroxidlösung
Durchführung: Das Waschmittel wird zusammen mit der Salzsäure in das Reagenzglas gegeben. Sofort Stopfen befestigen! Das entstehende Gas wird durch die Bariumhydroxidlösung im Becherglas geleitet.
Beobachtung: In der Bariumhydroxidlösung entsteht ein weißer Niederschlag, sobald das entstehende Gas durch die Lösung geleitet wird.
Auswertung: Die Salzsäure reagiert mit dem Natriumcarbonat im Waschmittel zu Natriumchlorid und Kohlenstoffdioxid.
Na2CO3 + 2 HCl → 2 NaCl + H2O + CO2
Das gasförmige Kohlenstoffdioxid entweicht und reagiert beim Durchleiten durch die Bariumhydroxidlösung mit dieser zu schwerlöslichem Bariumcarbonat.
Ba(OH)2 + CO2 → BaCO3 + H2O
Dieses fällt als weißer Niederschlag aus.
Experiment: Wirkung von Bleichmitteln
![]() Sicherheitshinweis: Natriumperborat ist giftig! Schutzkleidung und Schutzbrille tragen!
Sicherheitshinweis: Natriumperborat ist giftig! Schutzkleidung und Schutzbrille tragen!
Materialien: Reagenzgläser, Reagenzglasgestell, Baumwolllappen, Brenner
Chemikalien: Natriumperborat, Vollwaschmittel, Wasser, Tinte
Durchführung: Drei Fetzen des Baumwolllappens in Tinte tränken und in je ein Reagenzglas mit Wasser, Vollwaschmittel bzw. Natriumperborat geben. Auf etwa 50°C erhitzen.
Beobachtung: Der Baumwolllappen im Wasser entfärbt sich kaum, der Lappen im Reagenzglas mit dem Waschmittel ist hinterher noch leicht bläulich gefärbt, und der Lappen im Bleichmittel Natriumperborat wird wieder weiß.
Auswertung: Das Natriumperborat zerfällt und setzt dabei Wasserstoffperoxid frei. Dieses reagiert mit den im Wasser enthaltenen OH--Ionen zu Perhydroxyl-Anionen, welche die Tinte von der Baumwolle durch Bleichung entfernen.
NaBO2(OH)2 + H2O → NaH2BO3 + H2O2
H2O2 + OH- → H2O + HOO-
Da das Waschmittel nicht komplett aus Bleichmittel besteht, ist die Wirkung logischerweise geringer als beim Natriumperborat.
Experiment: Eigenschaften eines anionischen Tensids
![]()
![]() Sicherheitshinweis: Natronlauge und Salzsäure sind ätzend! Calciumchlorid ist reizend. Schutzkleidung und Schutzbrille tragen!
Sicherheitshinweis: Natronlauge und Salzsäure sind ätzend! Calciumchlorid ist reizend. Schutzkleidung und Schutzbrille tragen!
Materialien: Reagenzgläser, Reagenzglasgestell, Pipette, Uhrglasschale, Erlenmeyerkolben
Chemikalien: Tensid (z.B. Waschmittel oder Flüssigseife), Wasser, Universalindikator, Salzsäure, Natronlauge, Öl, Kochsalz, Calciumchlorid
Durchführung: Reaktionsverhalten in Wasser. Etwas Waschmittel in ein wenig Wasser lösen, pH-Wert ermitteln.
Reaktion mit Säuren und Basen. Erneut Tensid in Wasser lösen, zu einer Probe Salzsäure, zu einer anderen Natriumhydroxid zugeben und Veränderungen beobachten. Gegebenfalls pH-Wert ermitteln.
Benetzende Wirkung. Circa 5 ml Wasser auf eine Uhrglasschale geben, darauf eine Büroklammer o.ä. zum "Schwimmen" bringen. Flüssiges Tensid hinzugeben.
Emulgierverhalten. In zwei Erlenmeyerkolben Öl und Wasser geben. In einen der Kolben zusätzlich Tensid hinzugeben. Beide Kolben schütteln.
Wasserhärteempfindlichkeit. Calciumchlorid in Wasser lösen, Tensid dazugeben.
Aussalzen. Mit Natriumchlorid eine gesättigte Lösung herstellen, Tensid dazugeben.
Beobachtung: Reaktionsverhalten in Wasser. Das Tensid reagiert in Wasser basisch.
Reaktion mit Säuren und Basen. Bei Säurezugabe fällt ein weiß-grauer Niederschlag aus, bei Basezugabe geschieht nichts.
Benetzende Wirkung. Bei Zugabe eines Tensids sinkt die Büroklammer zu Boden.
Emulgierverhalten. Im Reagenzglas ohne Tensid setzt sich das Öl nach kurzer Zeit wieder an der Wasseroberfläche ab, im Reagenzglas mit Tensid bildet sich jedoch eine dauerhafte Emulsion.
Wasserhärteempfindlichkeit. Bei Zugabe von Calciumionen fällt ein weißer, nicht löslicher Niederschlag aus.
Aussalzen. In einer gesättigten Lösung fällt ein weißer Niederschlag aus, welcher bei Wasserzugabe jedoch wieder verschwindet.
Auswertung: Da es sich um ein anionisches Tensid handelt, enthält es mindestens eine Carboxylatgruppe (—COO-), die für viele der vorangehenden Beobachtungen verantwortlich ist. Mit Wasser z.B. reagiert ein geringer Teil des Tensids zu Fettsäuren und Hydroxidionen, welche die leicht basische Reaktion ausmachen:
R—COO- + H2O ⇋ R—COOH + OH-
Durch Basezugabe wird dieses Gleichgewicht entsprechend auf die Seite der Ausgangsprodukte verschoben, weshalb keine Reaktion festgestellt werden kann. Wird jedoch Säure hinzugegeben, verlagert sich das Gleichgewicht auf die Seite der Reaktionsprodukte, weil die Hydroxidionen aus dem Gleichgewicht entzogen werden. Hierbei kann aufgrund einer sehr geringen Rückreaktion von einem vollständigen Stoffumsatz ausgegangen werden.
R—COO- + H3O+ → R—COOH + H2O
Die nicht-wasserlöslichen Fettsäuren bilden einen weiß-grauen Niederschlag, welcher auch für das Vergrauen von Wäsche verantwortlich gemacht werden kann.
Die Wasserhärteempfindlichkeit von anionischen Tensiden lässt sich ebenfalls anhand der Carboxylatgruppe erklären:
2 R—COO- + Ca2+ → (R—COO)2Ca
Es bildet sich ein schwerlösliches Calciumsalz. Ähnlich verhält es sich bei Zugabe einer gesättigten Kochsalzlösung, jedoch ist dieser Prozess reversibel. Die etwas schlechtere Löslichkeit des organischen Salzes gegenüber dem Kochsalz führt hier dazu, dass es anstelle des Kochsalzes ausfällt.
Die benetzende Wirkung des Tensids und das Emulgierverhalten haben hingegen mit dem gesamten Aufbau eines Tensidmoleküls zu tun. Hier spielen die hydrophoben und hydrophilen Eigenschaften eine Rolle. Die Oberflächenspannung des Wassers wird durch das Tensid – wie im Kapitel über Seifenmoleküle beschrieben – heruntergesetzt, sodass die Büroklammer plötzlich durch die Oberfläche des Wassers "hindurchfällt". Ebenso wird das Öl im Wasser durch die Grenzflächenaktivität des Tensids im Wasser emulgiert.
Experiment: Herstellung von Seifen
![]() Sicherheitshinweis: Natronlauge ist ätzend! Schutzkleidung und Schutzbrille tragen!
Sicherheitshinweis: Natronlauge ist ätzend! Schutzkleidung und Schutzbrille tragen!
Materialien: Brenner, Dreifuß, Drahtnetz, Becherglas
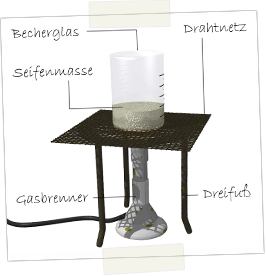 Chemikalien: Fett, Wasser, verdünnte Natronlauge (10-20%)
Chemikalien: Fett, Wasser, verdünnte Natronlauge (10-20%)
Durchführung: 10 mg Fett werden in 10 ml Wasser erhitzt und geschmolzen. Daraufhin werden 10 ml Natronlauge dazugegeben. 15 min kochen lassen. Anschließend verdampftes Wasser unter Rühren wieder auffüllen. Zähflüssige Seifenmasse einer Form trocknen lassen.
Beobachtung: Nach kurzer Zeit bilden sich weiße Seifenflocken, welche sich durch Wasserzugabe lösen lassen. Wenn getrocknet, wird die Masse fest.
Auswertung: Durch die Zugabe von Natronlauge zerfällt das Fett in seine Bestandteile (Fettsäuren und Glycerin). Zusammen mit den Natriumionen der Natronlauge reagieren erstere zu einem Salz, welches in Wasser löslich ist:
CH2—COO—RCH2—OH
||
CH—COO—R + 3 NaOH → CH—OH + 3 R—COO- Na+
||
CH2—COO—RCH2—OH
Wenn man diese Reaktionsprodukte trocknet, erhät man eine feste Seifenmasse.