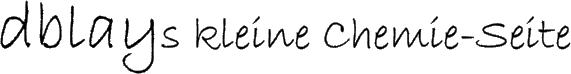Funktionsweise von Seifen
Bau und Eigenschaften von Seifenmolekülen
 Die Tensidklasse der Seifen besteht aus Natrium- oder Kaliumsalzen aliphatischer (d.h. nicht-cyclischer) Carbonsäuren von mittlerer Kettenlänge (n = 10 ··· 16):
Die Tensidklasse der Seifen besteht aus Natrium- oder Kaliumsalzen aliphatischer (d.h. nicht-cyclischer) Carbonsäuren von mittlerer Kettenlänge (n = 10 ··· 16):
CH3—(CH2)n—COO- Na+
Somit besteht ein Seifenmolekül aus einer langen unpolaren Kohlenwasserstoffkette und einem polaren Ende, der Carboxylat-Gruppe. Daher besitzen Seifenmoleküle ein hydrophiles und ein hydrophobes bzw. lipophiles Ende.
Als Folge dieses Molekülbaus liegen einzelne Seifenmoleküle im Wasser nicht in gelöster Form, sondern in so genannten "Micellen" vor. Hierbei befinden sich die langen unpolaren Kohlenwasserstoffketten im Inneren, während die polaren Enden ins Wasser hinausragen. Durch die daraus resultierenden Ladungen an den polaren Enden wird ein Zusammenklumpen der Micellen verhindert. Man unterscheidet zwischen "Kugelmicellen" und zylinderförmigen "Stabmicellen".
Mit der Zeit reichern sich die Seifenmoleküle an der Wasseroberfläche an, da die hydrophoben Kohlenwasserstoffketten aus dem Wasser gedrängt werden. So bildet sich eine monomolekulare Schicht von Seifenmolekülen aus, die die Oberflächenspannung des Wassers aufgrund der schwächeren Van-der-Waals-Kräfte zwischen den Molekülen deutlich senkt. So kann das Wasser z.B. besser in Kapillaren zwischen Fasern eindringen, was die Reinigungswirkung der Seife noch verstärkt.
Eng mit diesem Verhalten der Seifenmoleküle ist auch die Schaumbildung verbunden. Hierbei bilden sich viele kleine Luftbläschen aus, die von den Seifenmolekülen und einem durch die verringerte Oberflächenspannung sehr dünnen Wasserfilm umschlossen werden. Bei einem solchen Luftbläschen sind – im Gegensatz zur Micelle – die hydrophoben Enden der Seifenmoleküle sowohl nach innen als auch nach außen gerichtet, während die polaren Enden im Wasserfilm verbleiben.
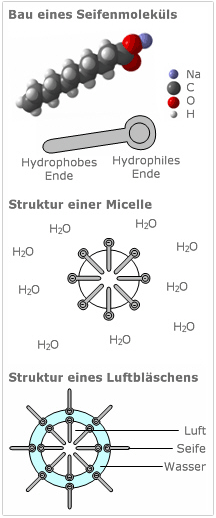
 Die an sich für Reinigungszwecke wichtigste Eigenschaft der Seife ist ihre Fähigkeit, Fette zu lösen. Da die lipophilen Kohlenwasserstoffketten einwandfrei im unpolaren Fett löslich sind, wirken die Seifenmoleküle als Emulgator zwischen dem Fett und dem Wasser. So bildet sich eine haltbare Öl-in-Wasser-Emulsion, die am Ende eines Waschvorganges abgeführt werden kann.
Die an sich für Reinigungszwecke wichtigste Eigenschaft der Seife ist ihre Fähigkeit, Fette zu lösen. Da die lipophilen Kohlenwasserstoffketten einwandfrei im unpolaren Fett löslich sind, wirken die Seifenmoleküle als Emulgator zwischen dem Fett und dem Wasser. So bildet sich eine haltbare Öl-in-Wasser-Emulsion, die am Ende eines Waschvorganges abgeführt werden kann.
Seifen können als grenzflächenaktive Stoffe folglich in die Klasse der anionischen Tenside eingeordnet werden.
Heutzutage werden Seifen allerdings immer mehr durch moderne Detergenzien ersetzt, da Seife durch ihre basische Reaktion Haut und Stoffe beschädigen kann.
R—COONa + H2O ⇋ R—COO- + Na+ + H2O ⇋ R—COOH + OH- + Na+
Des Weiteren bildet Seife in Zusammenhang mit "hartem" Wasser einen weißen Niederschlag – die so genannte Kalkseife, welche sich als Belag auf Gegenständen ablagert. Es handelt sich hierbei um ein schwer lösliches Calciumsalz:
2 R—COO- + Ca2+ → (R—COO)2Ca
Nichtsdestotrotz ist Seife aufgrund der unverzweigten Molekülstruktur biologisch problemlos abbaubar und wird deshalb auch häufig als Schaum-regulierendes Mittel eingesetzt.
Experiment: Herstellung von Seifen
![]() Sicherheitshinweis: Natronlauge ist ätzend! Schutzkleidung und Schutzbrille tragen!
Sicherheitshinweis: Natronlauge ist ätzend! Schutzkleidung und Schutzbrille tragen!
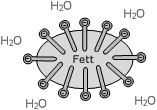
Materialien: Brenner, Dreifuß, Drahtnetz, Becherglas
 Chemikalien: Fett, Wasser, verdünnte Natronlauge (10-20%)
Chemikalien: Fett, Wasser, verdünnte Natronlauge (10-20%)
Durchführung: 10 mg Fett werden in 10 ml Wasser erhitzt und geschmolzen. Daraufhin werden 10 ml Natronlauge dazugegeben. 15 min kochen lassen. Anschließend verdampftes Wasser unter Rühren wieder auffüllen. Zähflüssige Seifenmasse einer Form trocknen lassen.
Beobachtung: Nach kurzer Zeit bilden sich weiße Seifenflocken, welche sich durch Wasserzugabe lösen lassen. Wenn getrocknet, wird die Masse fest.
Auswertung: Durch die Zugabe von Natronlauge zerfällt das Fett in seine Bestandteile (Fettsäuren und Glycerin). Zusammen mit den Natriumionen der Natronlauge reagieren erstere zu einem Salz, welches in Wasser löslich ist:
CH2—COO—RCH2—OH
||
CH—COO—R + 3 NaOH → CH—OH + 3 R—COO- Na+
||
CH2—COO—RCH2—OH
Wenn man diese Reaktionsprodukte trocknet, erhät man eine feste Seifenmasse.